近日,珠江水产研究所水产生物制品工程化与免疫生态防控团队在罗氏沼虾免疫防御机制方面取得进展,相关研究论文以“Autophagy enhances the antibacterial response in Macrobrachium rosenbergii by modulating cellular metabolism and immune pathways”和“BNIP3, targeted by miR-148 and miR-152, upregulates autophagy to inhibit Aeromonas hydrophila infection in the giant freshwater prawn Macrobrachium rosenbergii”为题,分别发表在国际学术期刊Fish & Shellfish Immunology(JCR一区)和Aquaculture(JCR一区)上。该研究得到中国水产科学研究院中央级公益性科研院所基本科研业务费专项(2025XK04和2023TD48)、广东省基础与应用基础研究基金(2023A1515110194)、广东农村科技特派员项目(KTP20240662)、岭南现代农业科学与技术广东省实验室肇庆分中心自主项目(P20211154-0102-01)等项目联合资助。珠江所为该论文第一完成单位,王飞飞助理研究员为第一作者,赵飞副研究员为通讯作者。
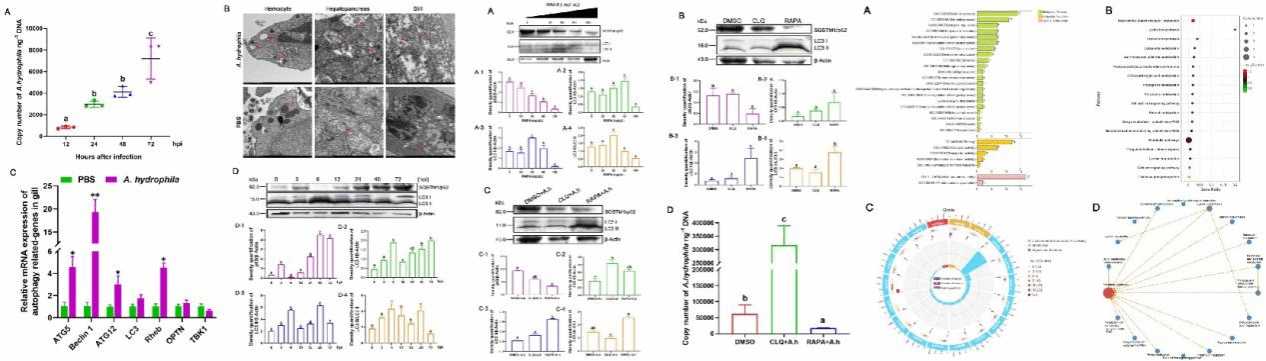
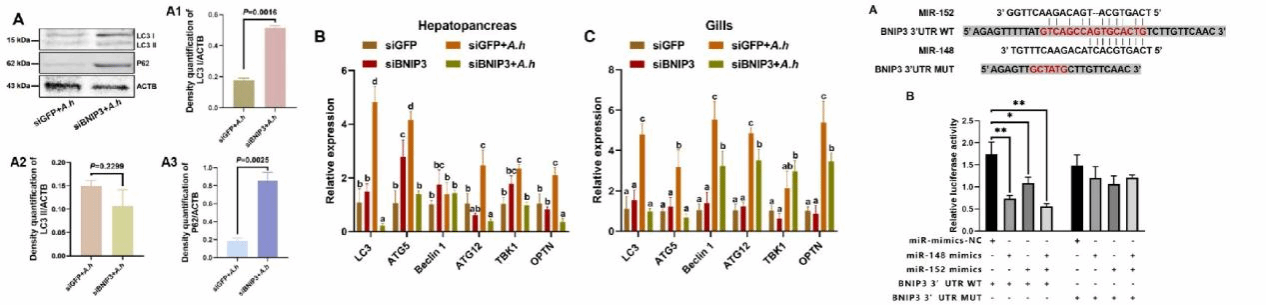
罗氏沼虾是我国重要的淡水经济虾种,2024年全国养殖产量达到24.56万吨,产业规模已连续三十年位居全球首位,贡献了全球超过50%的罗氏沼虾供应。然而,随着集约化养殖模式的推广和养殖密度的不断提高,养殖生态系统失衡所引发的细菌性疾病问题日益严重。前期研究发现,自噬在罗氏沼虾抵御细菌感染过程中发挥重要调控作用。本研究成功构建了罗氏沼虾自噬激活模型,揭示出自噬通过抑制代谢途径并增强免疫反应,从而提升机体的抗菌防御能力。同时,本研究克隆并功能鉴定了罗氏沼虾中的BNIP3基因(MrBNIP3),通过RNAi沉默MrBNIP3会抑制自噬活性并加重细菌侵袭。在机制层面,病原感染显著下调miR-148和miR-152的表达,从而解除其对MrBNIP3 3′-UTR区域的共靶向抑制,进而增强BNIP3介导的自噬与抗菌信号通路。综上所述,病原菌通过下调miR-148/152表达,解除对MrBNIP3的抑制,激活自噬流,重塑代谢-免疫平衡,最终限制病原菌的扩散。这一“miRNA–BNIP3–自噬”调控通路的发现,为深入理解甲壳类动物的先天免疫机制及探索病害防控新策略提供了重要的理论靶点。
全文链接:https://doi.org/10.1016/j.fsi.2025.110258; https://doi.org/10.1016/j.aquaculture.2025.743181